抗病毒先天免疫信号通路与低氧信号通路为细胞中两个经典且古老的信号通路,从高等脊椎动物到低等的无脊椎动物均高度保守。关于这两条通路之间的交互作用,尤其是氧气以及受氧气调控的关键因子在先天免疫信号通路中的作用和机制,是该领域关注的热点。近日,中国科学院水生生物研究所肖武汉团队发现,低氧信号通路核心转录因子HIF1a的抑制因子FIH(也称天冬酰胺羟化酶)在抗病毒先天免疫中具有重要作用。
研究通过前期的筛选发现,酶活与氧浓度相关的FIH能够与先天免疫信号通路中的IKKε相互结合。过表达FIH减弱了IRF3的磷酸化水平,抑制了先天免疫信号通路下游基因的表达,促进了病毒的复制;而当在细胞系敲除FIH,可得到相反的实验结果,表明FIH负调控病毒诱导的先天免疫信号通路。
由于FIH对先天免疫信号通路的调控依赖其羟化酶活性。研究通过筛选预测的各酶活突变体发现,当FIH第199位组氨酸突变成丙氨酸,FIH丧失了其对先天免疫信号通路的调控作用。由于FIH的酶活性与氧浓度相关,研究进而探讨了低氧状态下FIH对免疫信号通路的调控作用。结果表明,0.1%氧浓度状态下,抑制了FIH对先天免疫信号通路的调控。
FIH靶向调控IKKε,主要羟基化IKKε哪个天冬酰胺位点?该研究通过质谱法分析发现,FIH能够羟基化IKKε第254、700和701位天冬酰胺位点。进一步的分析显示,FIH通过羟基化IKKε第700、701位天冬酰胺位点,抑制IKKε与TBK1或TRAF3的结合。同时,泛素化实验结果表明,FIH通过羟基化IKKε第254位天冬酰胺位点,抑制IKKε第416位赖氨酸K63链接的多聚泛素化。泛素复合体cIAP1/cIAP2/TRAF2能够泛素化IKKε。研究对该复合体与FIH在IKKε泛素化过程中的作用分析发现,FIH抑制了cIAP1对IKKε第416位赖氨酸的泛素化。研究显示,通过敲降或敲除cIAP1,抑制了FIH对IKKε的调控。研究利用CRISPR/Cas9基因编辑技术构建了Fih敲除的斑马鱼和小鼠。病毒感染实验表明,敲除FIH显著增强了宿主抵抗病毒的能力。这一成果为先天免疫信号通路与低氧信号通路之间的交互作用提供了新证据。
12月22日,相关研究成果以Factor inhibiting HIF (FIH) negatively regulates antiviral innate immunity through hydroxylation of IKKε为题,发表在《细胞报告》(Cell Reports)上。研究工作得到国家自然科学基金创新研究群体项目和重点项目、中国科学院战略性先导科技专项(A类)、中国科学院特别研究助理资助项目、中国博士后科学基金等的支持。
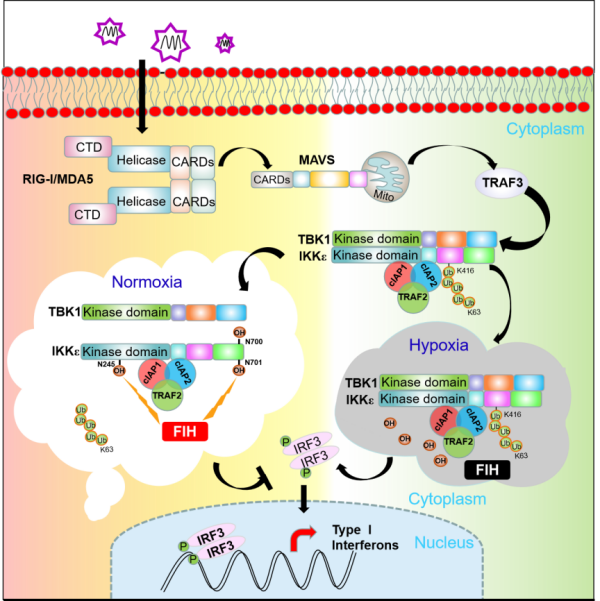
FIH在天然免疫通路中的调控模式图